الکتروشیمی تجزیه ای
الکتروشیمی شاخهای از شیمیفیزیک است که به بررسی رابطه بین الکتریسیته، به عنوان یک پدیده کمی و قابل اندازهگیری و تغییر شیمیایی و تاثیر این دو بر یکدیگر میپردازد. این واکنشها شامل حرکت بارهای الکتریکی بین الکترود و یک آنالیت می باشد. بنا به این تعریف، الکتروشیمی به رابطه بین انرژی الکتریکی و تغییر شیمیایی می پردازد.
یک واکنش الکتروشیمیایی زمانی اتفاق می افتد که یک تغییر شیمیایی در اثر یک جریان خارجی بوجود بیاید. این جریان خارجی در الکترولیز قابل مشاهده است.
زمانی که در واکنش شیمیایی، الکترونها به طور مستقیم بین مولکولها یا اتمها منتقل میشوند واکنش اکسایش کاهش (ردوکس) بوجود می آید.
از کاربردهای الکتروشیمی می توان به بررسی واکنش هایی که انجام آن ها باعث ایجاد جریان الکتریکی می شود اشاره نمود. انجام این واکنش ها با تغییر در عدد اکسایش همراه است. تمام واکنشهای الکتروشیمی نوعی واکنش اکسایش کاهش است.
درواقع مبادله الکترون قسمت اجتناب ناپذیر این واکنش ها به حساب می آید. واکنش هایی مانند زنگ زدن آهن و فاسد شدن مواد غذایی از واکنش های مضر اکسایش کاهش و الکتروشیمی محسوب میشوند. واکنش های مانند آبکاری فلزات و سوختن از واکنش های مفید اکسایش کاهش یا همان الکتروشیمی است.
بیشتر بخوانید: اسپکتروسکوپی تجزیه ای
انواع واکنش های الکتروشیمی
ممکن است انرژی که در واکنش های شیمیایی جذب یا آزاد می گردد به شکل انرژی الکتریکی باشد. الکتروشیمی به تبدیل انرژی شیمیایی و الکتریکی به یکدیگر می پردازد. هنگامی که در اثر جریان خارجی یک تغییر شیمیایی رخ دهد، یک واکنش الکتروشیمیایی به وقوع می پیوندد. این واکنش می تواند به صورت خود به خودی و یا غیر خودبه خودی صورت گیرد.
کار انواع باتریها، چراغ قوه، خودرو با واکنش های الکتروشیمیایی انجام می شود. کاربرد دیگر الکتروشیمی در آبکاری فلزات مشاهده میشود. انتقال پیام عصبی در بدن موجودات زنده نیز با الکتروشیمی قابل توضیح می باشد. همه این واکنشها بر اساس واکنش های ردوکس یا همان انتقال الکترون صورت می گیرد.
واکنش ردوکس
به واکنش هایی که باعث عدد اکسایش عنصری شوند نیم واکنش کاهش گفته می شود. واکنشی که در آن عدد اکسایش عنصری افزایش یابد، نیم واکنش اکسایش نام دارد. مجموع این دو نیم واکنش، واکنش اکسایش کاهش را ایجاد می کنند.
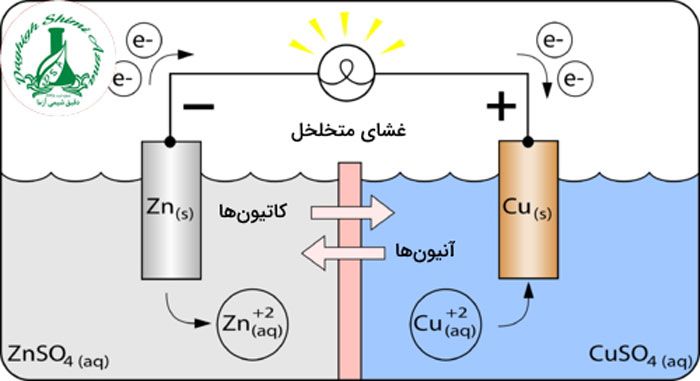
برای مثال، واکنش یون های مس (II) به عنوان واکنش های مستقیم اکسایش کاهش یا ردوکس (مستقیم ردوکس) شناخته می شود. در واکنش مستقیم ردوکس الکترون های انتقالی از اتم های سطح نوار روی (Zn) مستقیما به سمت یونهای مس موجود در محلول حرکت می کنند.
جریان الکتریسیته به یک محیط رسانا مثل یک سیم الکتریکی برای مسیر حرکت الکترون ها و انجام واکنش نیاز دارد. به عنوان نمونه، روشن کردن یک لامپ یا بکار انداختن سیستم گرمایشی را می توان نام برد. سلول های الکتروشیمی به این صورت عمل می کنند که در واکنشهای الکتروشیمیایی، فرآیندهای اکسایشی از فرآیندهای کاهشی جدا شده و الکترون از محلی به محل دیگر حرکت می کند. به بیان ساده تر، یک سلول الکتروشیمیایی دستگاهی است که انرژی های شیمیایی و الکتریکی را به هم تبدیل می کند.
برای انجام واکنش الکتروشیمی به سه مورد نیاز داریم:
1-یک محلول برای انجام واکنشهای ردوکس، معمولا برای تسهیل حرکت یون ها و الکترون ها این واکنشها در آب انجام می شوند.
2-برای انتقال الکترون ها به یک محیط رسانا نیاز است. اغلب برای این محیط رسانا از یک سیم الکتریکی استفاده می شود.
3-برای حرکت از بخشی به بخش دیگر به محیطی موسوم به پل نمکی احتیاج است.
سلول ولتاییک
سلول ولتاییک نوعی سلول الکتروشیمیایی است که برای تولید انرژی الکتریکی از واکنش های خود به خودی ردوکس استفاده می کند. یک سلول ولتاییک از دو بخش مجزا تشکیل یافته است که در هر یک، نیم واکنش های اکسایش یا کاهش و نه هر دو انجام میشوند. یک نیمسلول شامل نوار فلزی روی در محلولی از سولفات روی و نیمسلول دیگر حاوی نوار مسی در محلول مس (II) سولفات می باشد. این نوارهای فلزی الکترود نام دارد. الکترود نوعی رسانا در مدار است که جهت حمل الکترون ها به بخش نافلزی مدار مورد استفاده قرار می گیرد.
منظور از بخش نافلزی مدار، محلول الکترولیت است که الکترود ها در این محلول قرار میگیرند. الکترودها توسط سیمی فلزی به یکدیگر متصل میشوند. قطع و وصل مدار نیز توسط یک کلید انجام می گیرد. برای تکمیل مدار از غشایی متخلخل بین دو نیم سلول استفاده می شود.
انواع سلول الکتروشیمی
سلول گالوانی
سلول گالوانی به سلول ولتایی نیز معروف است. انرژی الکتریکی در نوع گالوانی با استفاده از انرژی آزاد شده در زمان انجام واکنش خود به خودی اکسایش کاهش تولید می شود.
سلول الکترولیتی
سلول الکترولیتی با مصرف انرژی الکتریکی یک منبع خارجی، انرژی الکتریکی را به انرژی شیمیایی تبدیل می کند.
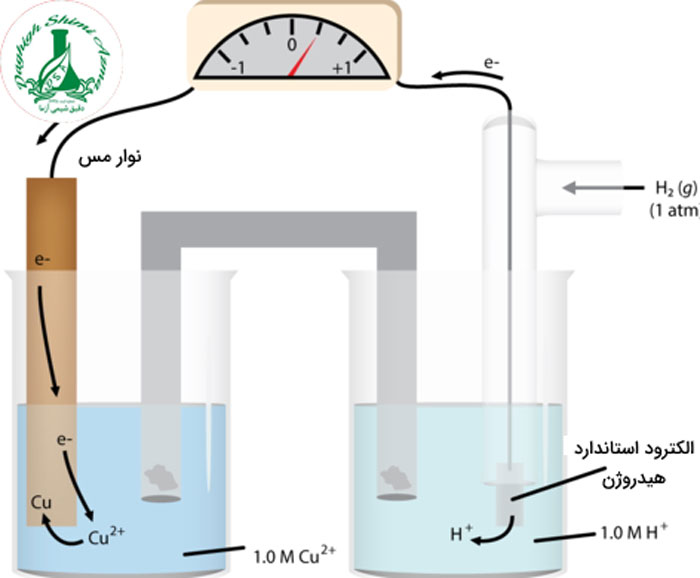
الکتروشیمی و پتانسیل الکتریکی
پتانسیل الکتریکی یک معیار است برای سنجش توانایی یک سلول ولتاییک برای تولید جریان الکتریکی می باشد. واحد پتانسیل الکتریکی ولت می باشد. اختلاف پتانسیل الکتریکی بین دو نیم سلول، ولتاژی است که یک سلول ولتاییک تولید می کند. بنابراین پتانسیل الکتریکی یک نیم سلول مجزا قابل اندازه گیری نخواهد بود. اگر یک نیم سلول روی ساخته شود، هیچ واکنش اکسایش و کاهشی به تنهایی در آن رخ نخواهد داد. بنابراین هیچ پتانسیل الکتریکی را نمی توان اندازه گیری کرد. به بیان دیگر، اختلاف پتانسیل زمانی که نیم سلول دیگری با نیم سلول روی ترکیب شود بوجود خواهد آمد.
پتانسیل الکتریکی سلول در الکتروشیمی در نتیجه رقابت بین الکترون ها به وجود میآید. مثلا در سلول ولتاییک روی مس، یون مس به فلز مس کاهش می یابد. چون یون های مس برای الکترون ها جاذبه بیشتری نسبت به روی دارند.
به معیار اندازه گیری تمایل یک نیم واکنش جهت وقوع در یک سلول الکتروشیمیایی پتانسیل کاهش گفته می شود که به صورت واکنشی کاهشی است. واکنش کاهش در نیم سلولی رخ می دهد که پتانسیل کاهش بیشتری دارد. واکنش اکسایش نیز در نیم سلولی رخ می دهد که پتانسیل کاهش کمتری داشته باشد. بنابراین در سلول الکتروشیمیایی به اختلاف پتانسیل کاهش بین دو نیم سلول، پتاسیل سلول گفته می شود.
الکترولیز آب در الکتروشیمی
الکترولیز آب منجر به آزاد شدن گازهای هیدروژن و اکسیژن می شود. سلول الکترولیتی شامل یک جفت الکترود پلاتینی است که در آب غوطه ور شده است. یک الکترولیت همچون H۲SO۴ نیز اضافه می شود. الکترولیت در الکترولیز آب از ضروریات واکنش است. چون آب خالص یون کافی ندارد، توانایی حمل بار الکتریکی نیز نخواهد داشت.
آب در آند به گاز اکسیژن و یون هیدروژن تبدیل می شود. در کاتد هم با واکنش کاهشی، آب به گاز هیدروژن و یون هیدروکسید تبدیل خواهد شد. اکسایش در آند و کاهش در کاتد صورت می گیرد. یون هیدروژن و هیدروکسید که در هر نیم واکنش تولید می شوند، در ترکیب با یکدیگر، آب تشکیل میدهند. H۲SO۴ نیز در واکنش مصرف نمی شود.
الکتروشیمی و آبکاری
بسیاری از اشیا تزئینی به کمک آبکاری ساخته می شوند. به فرآیندی که باعث کاهش یون فلزی در سلول الکترولیتی می شود و فلز بر روی یک سطح رسوب میکند، آبکاری گفته می شود.
سلولی را نظر بگیرید که از یک محلول مس (II) سولفات و نواری از مس تشکیل شده است و نقش آند را دارد. فلز M را می توان به این سلول وارد کرده تا کاتد را تشکیل دهد. آند به الکترود مثبت باتری و فلز به الکترود منفی متصل می گردد. وقتی مدار بسته شد، فلز مس در بخش آند اکسید شده و یون های مس وارد محلول می شوند. همزمان یون های مس موجود در محلول، پس از واکنش کاهشی به صورت فلز بر روی سطح کاتد رسوب میکنند. چون در آبکاری، فلز از بخش آند به بخش کاتد سلول انتقال می یابد، غلظت یون های مس در محلول ثابت می ماند.
از فلزاتی که به طور معمول از طریق آبکاری بر روی دیگر فلزات نشانده می شوند می توان کروم، طلا، نقره و پلاتین را نام برد.
الکتروشیمی در باتری
سلول های خشک
باتری های معمولی مانند باتری چراغ قوه یا کنترل تلویزیون، نوعی از سلول های خشک ولتاییک هستند. چون الکترولیت این نوع باتری ها خمیری است، به آن ها سلول خشک گفته می شود. این نوع سلولها عمر پایینی داشته و قابل شارژ مجدد هم نیستند و در نتیجه قیمت پایینی دارند. وجود خمیر در این باتری ها باعث می شود محتویات سلول خشک به راحتی با یکدیگر مخلوط نشود و بنابراین به پل نمکی نیازی ندارند.
بیشتر بخوانید: روش های تشخیص مواد شیمیایی اصل و تقلبی
عملکرد باتری سربی
باتری ها مجموعه ای از سلولهای الکتروشیمیایی هستند که در ترکیب با یکدیگر، منبعی از برق مستقیم با ولتاژ ثابت را به وجود می آورند. سلول های خشک، باتری محسوب نمی شوند چون فقط از یک سلول تشکیل شده اند. باتریهای سربی اغلب در وسایل نقلیه استفاده می شوند.
این باتریها معمولا از اتصال شش سلول به ساخته شده اند که هریک از این سلولها، آندی از سرب و کاتدی از جنس سرب (IV) اکسید PbO۲ دارند. آند و کاتد درون صفحه ای فلزی تعبیه شده اند. محلول آبی سولفوریک اسید محلول الکترولیت بوده که کاتد و آند در آن غوطه ور شده است. در هر سلول در این نوع از باتریها، ولتاژی برابر با ۲ ولت تولید می شود. در یک باتری شش سلولی، ۱۲ ولت برق تولیده می شود که از آن برای روشن کردن خودرو یا سیستم های الکتریکی استفاده می می شود.